Маркировка лекарственных препаратов. Как войти в систему маркировки, 36 ак.ч.
1. Правовые и методологические основы Системы маркировки лекарственных препаратов. Включение в Систему маркировки
1.1 Основные понятия маркировки лекарственных препаратов
1.2 Правовые и методологические основы Системы маркировки лекарственных препаратов
1.2.1 Приоритетный проект «Лекарства. Качество и безопасность»
1.2.2 Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» в части касающейся маркировки лекарственных средств
1.2.3 Модель функционирования системы маркировки товаров средствами идентификации в Российской Федерации
1.2.4 Порядок проведения эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов
1.3 Основные принципы мониторинга движения лекарственных препаратов
1.4 Инструкция оператора по подключению медицинских организаций и аптек к ИС МДЛП
1.5 Регистрация Личного Кабинета в ФГИС МДЛП
2. Работа в Системе маркировки ЛП с использованием программного продукта «Парус – Учет маркированных товаров»
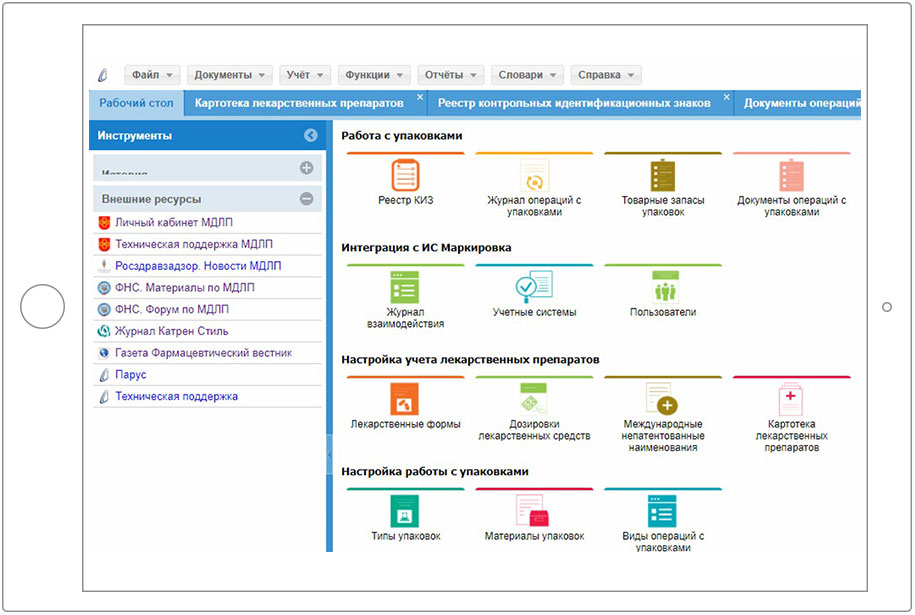
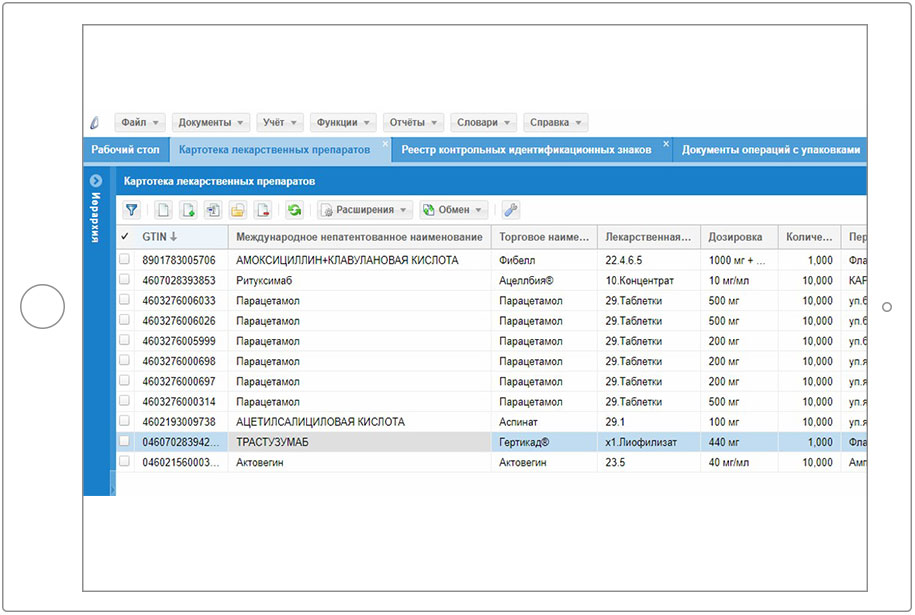
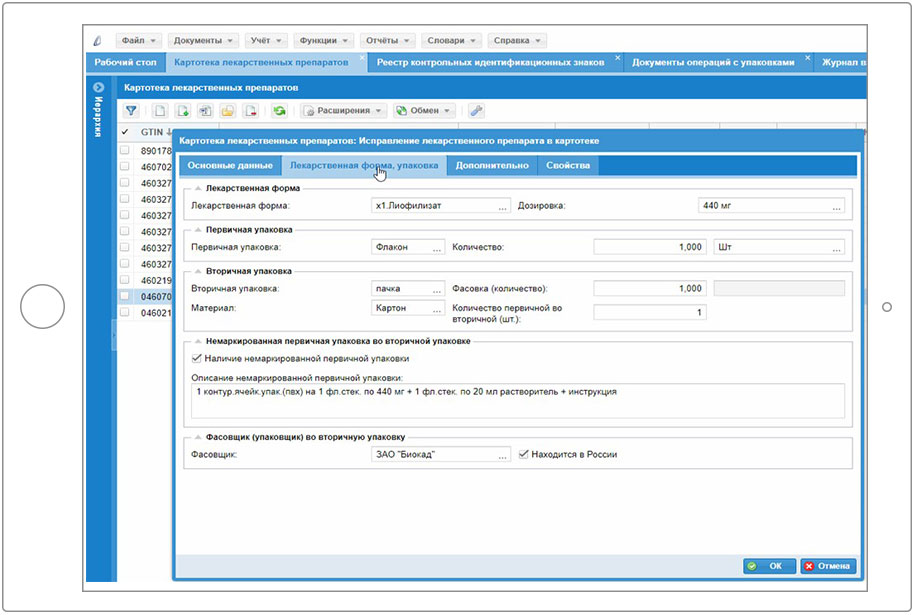
2.1 Решение Корпорации Парус «Парус – Учет маркированных товаров»
2.2 Работа в Системе маркировки с использованием ПП «Парус – Учет маркированных товаров»
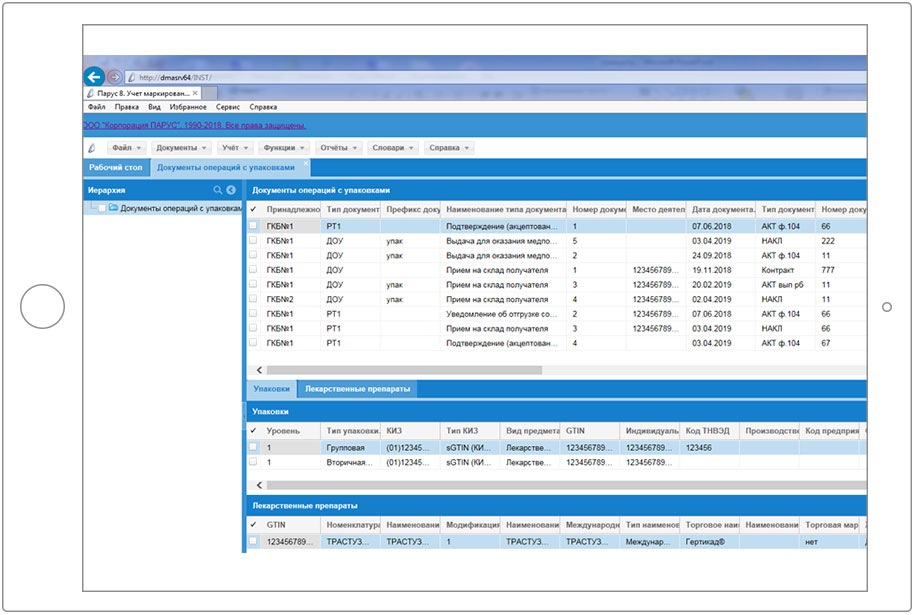
2.2.1 Процесс «Получение ЛП»
2.2.2 Прямая схема
2.2.3 Обратная схема
2.2.4 Процесс «Выдача ЛП в отделения»
2.3 Рабочие инструкции по использованию ПП «Парус – Учет маркированных товаров»
2.3.1 Инструкция по прохождению контрольного тестирования в тестовом контуре МДЛП «Песочница» с использованием ПП «Парус – УМТ»
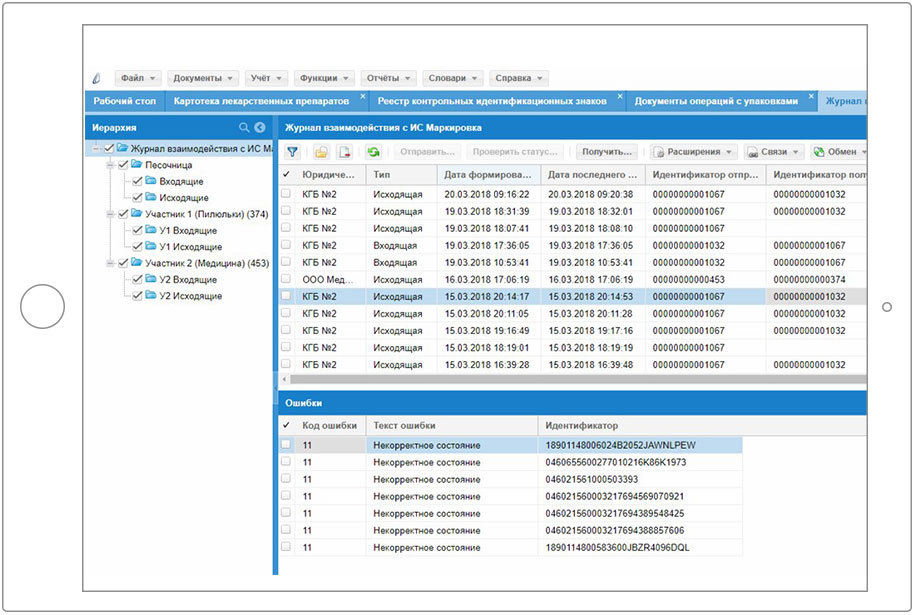
2.3.2 Инструкция по взаимодействию с ФГИС МДЛП с использованием ПП «Парус – УМТ»
2.4 ИС «Парус - Учет маркированных товаров» – перспективное решение от надежного поставщика!
 Баллы в системе НМФО
Баллы в системе НМФО